
CONTENTS
INTRODUCTION
電子顕微鏡の分解能 Å=オングストロームBEGINNING
画期的な創薬のためには、膜タンパク質の構造を知ることが大切
BREAKTHROUGH
液体ヘリウムでの冷却時の振動防止ステージ
FOR THE FUTURE
最高性能の電子顕微鏡が生み出す世界的な研究成果
FACE
30年来のパートナーシップが、基礎研究から新製品を生んだ
INTRODUCTION 概要
電子顕微鏡の分解能 Å=オングストローム
かつて薬は、経験的に効果が知られている物質をもとに開発されました。しかし、医学・生物学の進歩で、医薬品の対象は、全身から臓器へ、臓器から細胞へ、さらには、細胞を構成する分子へと精緻化しています。分子の中でも病気の原因となるタンパク質が次々に明らかになり、新薬開発は様変わりしました。病気の原因となるタンパク質の働きを正常に近づける物質が、薬として開発されるようになったのです。とくに、細胞表面に存在する膜タンパク質は、医薬品の重要なターゲットとなっています。京都大学大学院理学研究科の藤吉好則教授は、電子顕微鏡メーカーの日本電子株式会社と、極低温電子顕微鏡を共同開発しながら、膜タンパク質の構造解析を行っています。NEDOでも、この共同研究を支援してきました。
BIGINNING 開発への道
画期的な創薬のためには、膜タンパク質の構造を知ることが大切
タンパク質の中でも、細胞の表面に存在する膜タンパク質は、細胞への物質と情報の出入りをコントロールする重要な働きをしています。膜タンパク質がうまく働かなければ、細胞にうまく情報が伝わらないために、細胞、さらには組織・器官の働きにも異常が生じることがあります。このため、膜タンパク質は病気と関わる場合も多く、これを対象とした薬が世界中で盛んに開発され、使われています。たとえば、胃潰瘍の薬として広く知られるH2ブロッカーは、膜タンパク質の一種であるヒスタミン受容体に結合してその働きを抑え、胃酸の分泌を抑えるものです(図1-1参照)。
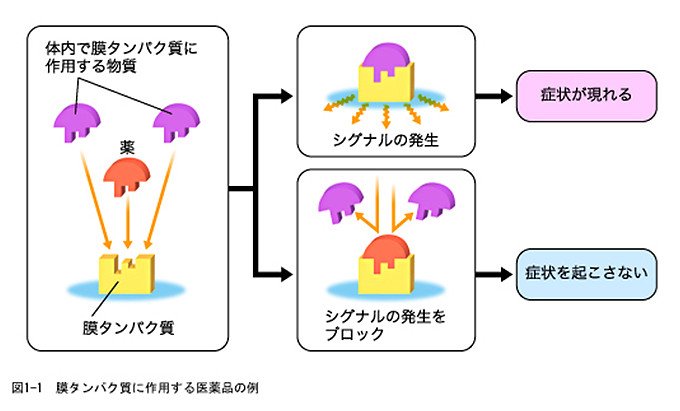
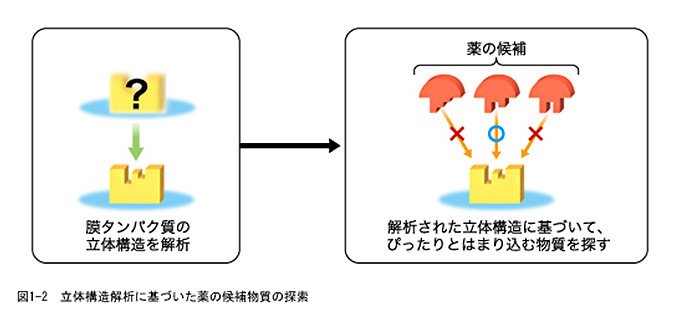
こうした薬の候補を効率よく見つけるため、近年、膜タンパク質の形(立体構造)を知り、狙った場所にぴたりとはまり込む物質を探すという戦略が出てきました(図1-2参照)。その背景には、タンパク質の立体構造を調べる解析技術の進歩があります。しかし、タンパク質の中でも、膜タンパク質は解析用のタンパク質の取得、結晶化などが困難であり、立体構造を解析するのがとても難しいのです。
このため、NEDOでは、「生体高分子立体構造情報解析プロジェクト」を立ち上げ、その中で、京都大学大学院理学研究科の藤吉好則教授は日本電子株式会社とともに、膜タンパク質の立体構造を詳しく調べるのに適した電子顕微鏡の開発に取り組みました。
膜タンパク質を調べるには最適の電子顕微鏡だが、使える製品の開発が必要だった
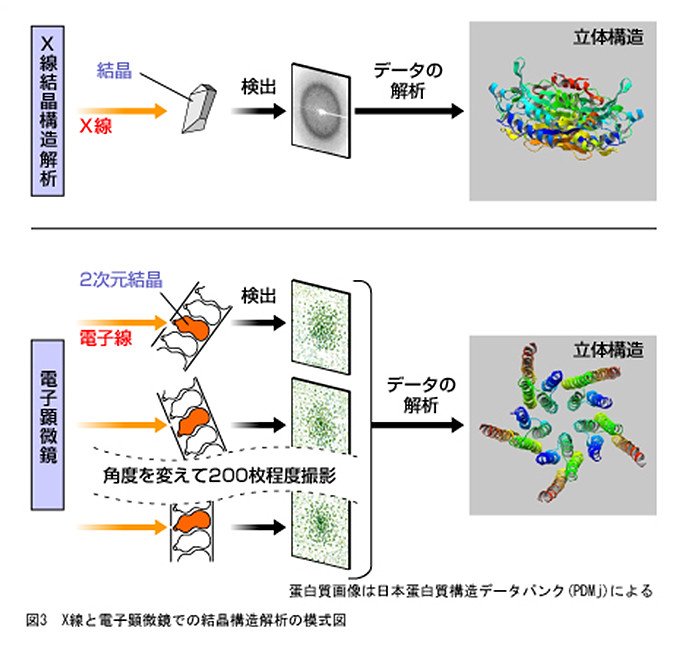
タンパク質の立体構造を調べるには、主にX線結晶構造解析(なるほど基礎知識参照)という手法が使われています。多くの構造が解析されている強力な方法ですが、そのためには、タンパク質を立体的に並べた3次元結晶を準備する必要があります。それゆえ、膜に埋まった状態の膜タンパク質を調べるのは、困難な場合があります。
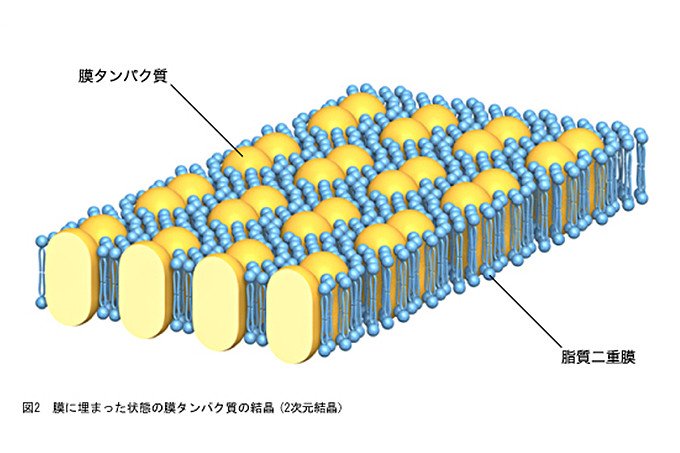
一方、電子顕微鏡は、電子線を観察対象に当てて、詳細に形態を観察する装置です。同時に電子線回折像も得られ、両方の像を用いてタンパク質の立体構造を調べることができます。電子顕微鏡を用いる場合は、膜の中に膜タンパク質が埋まった状態の結晶(2次元結晶、図2参照)を試料として使えるので、細胞膜に埋まっているもともとの環境により近づけて、膜タンパク質の立体構造を調べることができます。また、2次元結晶を作る際は、3次元結晶より少量のタンパク質で済むことがあるという利点もあります。
しかし、そのためには、従来からある電子顕微鏡では、性能や機能が不十分でした。膜タンパク質を調べるには、照射した電子線による損傷を最小限にとどめるため、極低温で何度も試料を交換して像を得る必要があります。さらに、観察試料の調製法など周辺技術の開発も必要でした。藤吉教授と日本電子は、膜タンパク質など生体高分子の構造解析のため、高解像度で使い勝手の良い電子顕微鏡を次々と創り出し、改良を続けています。

(左)生体高分子の構造解析と電子顕微鏡開発の第一人者、藤吉好則教授
(右)藤吉教授と日本電子が共同開発し、京都大学で使用されている極低温電子顕微鏡
きっかけは脳への興味。
膜タンパク質構造解析への挑戦は、低温観察できるステージ開発に始まる
藤吉教授と日本電子の共同研究が始まったのは、NEDOプロジェクトよりずっと以前、1983年のことでした。藤吉教授は、1978年に世界で初めて電子顕微鏡で1個1個の原子(塩化フタロシアニン銅という化合物の中の銅原子)を完全に分離して疑う余地なく見ることに成功した、この分野の第一人者です。共同研究では、電子顕微鏡とは何かという基本に立ち返り、分解能(どれだけ細かいものを見分けられるか)を高めることを目指しました。

塩化フタロシアニン銅の 1.8Å分解能の電子顕微鏡像
Chemica Scripta. 14, 47-61 (1978/79)より
藤吉教授がもともと興味を持っていたのは脳の働きでした。当時から、将来は脳細胞間の情報伝達に欠かせない、膜タンパク質の立体構造を、電子顕微鏡で調べようと考えていました。しかし、タンパク質は有機物であるため、分解能を高めるために強い電子線をあてると壊れてしまうのです。これを防ぐには、液体ヘリウム温度(数K:約-270℃)で測定すればよいことを、藤吉教授は確かめ、まず、液体ヘリウム温度で観察できるステージ(試料を載せる台)の開発に取り組みました。
しかし、ステージを液体ヘリウム温度まで冷やすことは容易ではありませんでした。そこで、当時、京都大学理学部でヘリウムの超流動を研究していた水崎隆雄教授の指導を受け、液体ヘリウム温度を達成するには、その前に液体窒素で周囲をあらかじめ冷やしておくなどの設計ポイントを教えてもらったと、藤吉教授は説明します。
タンパク質の立体構造をクリアにとらえるための様々な工夫
共同研究当初からプロジェクトまでを通じて、液体ヘリウム温度より低い超流動ヘリウム温度まで冷却でき、冷却時に振動が起こらないステージが開発されました。分解能を高めるために、極低温にして強い電子線をあてられるようにしても、ステージが振動すれば分解能は悪くなり、台無しになってしまうからです。極低温にすることと、振動を防ぐことを両立させるのは困難でしたが、設計の工夫などにより、見事に達成することができました(ブレークスルー参照)。
これにより、共同研究を始めた当初はステージの温度が10K(絶対温度10度)、分解能が12オングストローム(10億分の1m)程度であったのが、1.5K、最高2.0オングストロームへと大幅に向上したのです。
その一方で、藤吉教授は、周辺技術のアイディアも次々に生み出しました。まず、試料となる膜タンパク質を氷に閉じこめる技術(氷包埋法)が海外で開発されたので、その方法が適用できるシステムを開発しました。膜タンパク質の2次元結晶は水で取り巻かれていると安定ですが、電子顕微鏡の中は真空度が高いため、そのまま装着するとその水分が蒸発し、タンパク質の構造が変わってしまいます。また、ゆっくり凍ると水が結晶になるために試料を壊してしまいます。これらを防ぐため、試料を瞬間的に氷に閉じ込めるわけです(図4)。
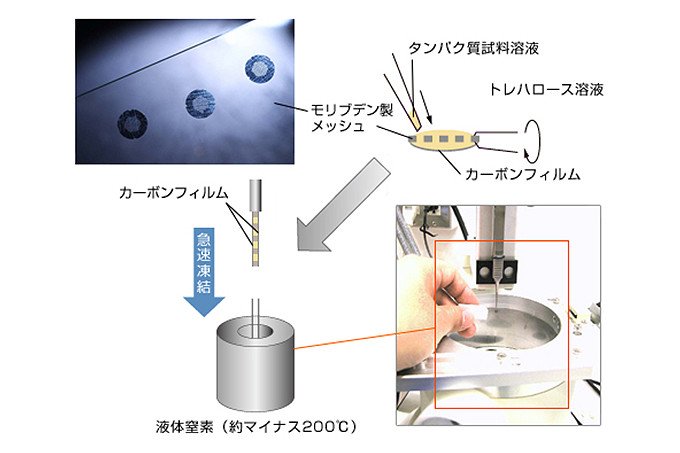
図4 氷包埋法 モリブデン製のメッシュにトレハロース溶液を保持しておき、そこに膜タンパク質を加えて上と下の両側にカーボンフィルムをつけ、液体窒素で急冷する。

最新の極低温電子顕微鏡の自動試料交換装置
さらに、氷に閉じこめた試料を、ボタン1つで電子顕微鏡に装着できる自動試料交換装置も開発しました。電子顕微鏡でタンパク質の立体構造を解析するには、最適の試料を作製する必要があります。それには試料を何度も入れ替えて最適な条件を見つける必要がありますが、この装置により、撮像に要する時間が大幅に短縮されました。
その他にも高い分解能のデータを収集するためには多くの技術開発が必要で、構造解析に利用できる画像の取得効率を2%から95%へと飛躍的に向上させることができる方法等を開発しました。
NEDOプロジェクトだからできた製品化
藤吉教授と日本電子が共同開発した電子顕微鏡は、日本電子が、製品として標準的な電子顕微鏡2種(300kVと200kVの電界放出型)に、極低温ステージと自動試料交換装置を組み込んだものを発売しています。日本だけでなく、米国や欧州各国でも販売実績があります。これらの製品は、その優れた性能が評価され、平成17年度(第4回産学官連携推進会議産学官連携功労者表彰)科学技術政策担当大臣賞を受賞しました。また、周辺技術に必要な装置の一部も、日本電子や他のメーカーから発売されています。

藤吉教授と日本電子が共同開発した最新世代の電子顕微鏡
共同研究の最初から藤吉教授と苦楽をともにしてきた日本電子の成瀬幹夫常務執行役員は、「この電子顕微鏡は創薬と科学の進歩に貢献することを主眼として、性能を極限まで追求したものです。その開発に企業が全面的に協力するには、NEDOに支援していただけた事がありがたかったです。また、開発の結果、販売実績や表彰などを通して、電子顕微鏡メーカーとしての実力を認めてもらえたことが、うれしかった」と語ります。
一方、藤吉教授は、「私の研究は基礎研究ですが、製品が広く使われるように、色々な努力をしています。広く使われる製品をつくることで、日本電子の信頼が高まり、次の開発に協力してもらいやすくなる。その繰り返しです。成瀬さんと共に技術者の青木好則さんが居られなければ、この装置を実用化できなかったと思います」と振り返ります。
BREAKTHROUGH プロジェクトの突破口
液体ヘリウムでの冷却時の振動防止ステージ
電子顕微鏡は高さが数mもある大きな装置ですが、膜タンパク質の立体構造解析を行うには、その100億分の1にあたるオングストローム単位の分解能が要求されます。サイズは大きいが、とてもデリケートな扱いが必要な装置なのです。床の振動、人の話し声などでさえ、分解能に影響するので、防振工事や防音工事をした部屋に設置します。さらに、冷却剤である液体窒素や液体ヘリウムの沸騰(バブリング)による振動がステージに伝わることも大きな問題となります。
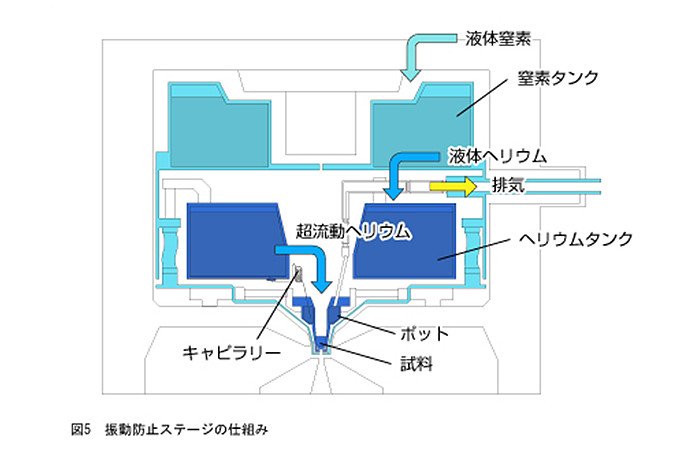
これを防ぐため、日本電子と藤吉教授は様々な工夫をしました。1つは、超流動ヘリウム温度まで冷却できるようにしたポットだけを試料微動台にのせて、バブリングが激しい液体ヘリウムタンクから試料台へと振動が伝わらなくしたことです。そのため、図5に示すように液体ヘリウムタンクから細い管(キャピラリー)で液体ヘリウムを小さいポットへと導き、ヘリウムタンクの振動がポットやそれをのせている試料微動台に伝わらないようにしました。
もう1つは、ポットとステージを保持する材料とその形の工夫です。ステージを低温に保つには、材料は熱を伝えにくいほうがよいので、金属ではなく繊維強化プラスチックを用いました。材料を薄くすれば熱を伝えにくくなりますが、強度が足りなくなってしまいます。熱の伝えにくさと強度とを両立させるため、日本電子は、設計に非常に苦労しました。試作と改良を繰り返してようやく振動防止ステージの実現にいたったのです。
FOR THE FUTURE 開発のいま、そして未来
最高性能の電子顕微鏡が生み出す世界的な研究成果
開発してきた製品や試料作製技術などにより、結晶の得られにくい膜タンパク質の構造を、少ない枚数の回折像から精密に(従来より高い解像度で)解析することが可能になりました。藤吉教授の研究室ではハーバード大学のThomas Walz教授(学生の時から藤吉教授のところに来て共同研究を行っている)と共同で、眼球の水晶体にある膜タンパク質であるアクアポリン-0の立体構造を1.9オングストローム分解能で解析することに成功し、2005年12月のNature誌に発表しました。
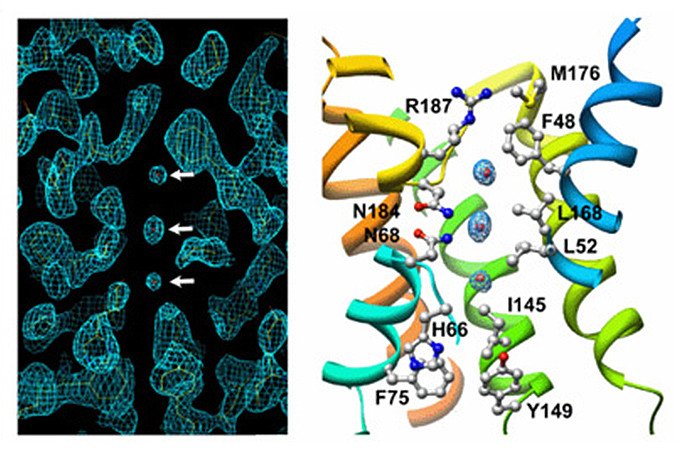
図6 アクアポリン-0の立体構造(水の通り道の部分)
これは、ヒト由来の膜タンパク質として世界で初めて立体構造が解析されたアクアポリン-1(2000年の10月にNature誌に発表され、藤吉教授の共同研究者のP.Agre教授が2003年にノーベル賞を受賞することになった水チャネル)と同じ仲間です。水分子の位置を電子顕微鏡で解析できたのも世界初で、水の通り道にある水分子が可視化されたことにより、アクアポリン-1の解析で提案した水がどのように運ばれるかというメカニズムがより確かになりました。しかも、この解析のためのデータ取得に要した期間はわずか2週間でした。
藤吉教授は、これ以外に、脳の細胞の膜にあり、脳浮腫や多発性硬化症などとの関連があると考えられているアクアポリン-4(3.2オングストローム分解能とそれをさらに2.8オングストローム分解能まで改良して、このチャネルでも水分子をきれいに観察)、神経シナプスや免疫システムの働きを知る上で重要な、細胞と細胞をつなぐ通路をつくるコネキシン-26(10オングストローム分解能)の構造も明らかにしています。いずれも、創薬につながると期待される成果です。
基礎的な生物学研究への応用例としては、大阪大学大学院生命機能研究科の難波啓一教授が、べん毛モーターの回転の仕組みの研究に、開発された極低温電子顕微鏡を使用しています。
より広く使われる装置、より深い技術開発をめざして
このNEDOプロジェクトでは、電子顕微鏡による立体構造解析の他に、NMRによる立体構造解析、コンピュータソフトの開発(タンパク質のポケットに入る化合物の探索など)も行われてきました。それぞれの研究者が互いに協力しあうことで、タンパク質の構造に基づく創薬に向けて大きな前進がありました。また、成果の普及をめざす蛋白質立体構造解析NEDO特別講座※が開催され、電子顕微鏡による立体構造の解析手法の普及に役立っています。
※タンパク質の立体構造解析分野の人材育成、成果普及、情報融合を目指し、企業・大学の研究者を対象として講義と実習を実施。
(https://www.nedo.go.jp/activities/AN_00011.html)

構造解析された結果は、3D(立体画像)化することもできる
しかし、一つのプロジェクトの終了が開発や研究の終了ではありません。藤吉教授の次の開発目標は、なるべく多くの研究者が行えるように周辺装置を改良していくことです。たとえば、冷却剤であるヘリウムは高価なので、繰り返し使えるようにするため、回収して冷却する装置を開発しています。
また、より構造解析の難しいタンパク質を解析することも大きな目標です。膜タンパク質のなかでも創薬にとって重要なのは、Gタンパク質共役型受容体(GPCR)というグループのものです。しかし、GPCRは膜内で安定な構造をとりにくい性質があるため、これまでに構造が解析されたのはロドプシンの他、アドレナリン受容体(α、β)など数種類のみです。
藤吉教授も、GPCRの一つであり高血圧等とも関係するエンドセリン受容体の構造解析に取り組んでおり、これを成功させるため、結晶化条件検索を行うとともに、より複雑な生物試料の構造研究を行うために、電子線トモグラフィー用電子顕微鏡の開発、解析ソフトの高度化などの技術開発を、現在実施中の「創薬加速に向けたタンパク質構造解析基盤技術開発プロジェクト」で進めています。これまでに蓄積してきた手法を生かし、新しい技術と総合化することにより、難敵に挑んでいく決意です。(2009年12月取材)

液体ヘリウム回収装置がついた電子顕微鏡
開発者の横顔
30年来のパートナーシップが、基礎研究から新製品を生んだ
脳に興味をもつ藤吉教授は、タンパク質の構造を解析するだけでなく、その先に、脳の仕組みを説明する新たなパラダイムを求めて日夜研究に打ち込んでいます。「企業にも必要な『実用化』のための真の研究は、実用化も念頭に置いた『基礎研究』だと信じています」と語る藤吉教授は、多忙であるにもかかわらず、実験の先頭に立ち、自ら手を動かす中で、困難をクリアするためのアイデアを次々に生み出しています。

日本電子株式会社 藤吉教授
日本電子の成瀬さんは、藤吉教授が最初に日本電子を訪ねた1983年からずっと、社内の技術者を束ね、開発担当の青木好則さんと共に藤吉教授のアイデアを形にしてきました。「藤吉先生は日本電子の研究室に泊まり込んでしまう程熱意があり、私も青木もこれに引き込まれました。そうでなければ、開発はできなかったでしょう」と藤吉教授の熱意に根負けしたことを認めます。

日本電子株式会社 成瀬常務
なるほど基礎知識
タンパク質の立体構造解析
X線結晶構造解析と電子顕微鏡
タンパク質は、アミノ酸がたくさんつながった長い1本のヒモが複雑に折りたたまれたものです。このヒモがどのように折りたたまれているのか、つまり、タンパク質をつくっているアミノ酸の1個1個、さらには、アミノ酸をつくっている原子の1個1個がタンパク質の中のどの位置にあるのかを調べるのが立体構造解析です。タンパク質はとても小さいので、ふつうの顕微鏡では調べることができず、X線や電子線を使います。
X線結晶構造解析は、タンパク質が立体的に並んだ3次元結晶をつくってX線をあて、そのときに得られる回折データから立体構造を導き出す手法です。一方、電子顕微鏡で電子線をあてる場合は、タンパク質が平面的に並んだ2次元結晶を用います。膜中のタンパク質をそのままに近い形で解析できる点で、膜タンパク質の構造解析に適していますが、構造解析には、試料の条件によりますが、200枚程度の電子線回折像を撮影する必要があります。一般には1つの試料につき、一度しか撮影ができないので、試料を替えて何度も撮影を行います。
お読みいただきありがとうございました。
ぜひともアンケートにお答えいただき、
お読みいただいた感想をお聞かせください。
いただいた感想は、
今後の連載の参考とさせていただきます。



