CONTENTS
INTRODUCTION
糖鎖合成ブロックの製造量100g単位→100kg単位へ
BEGINNING
細胞の表面を覆う糖鎖、「細胞の顔」として血液型から
インフルエンザまで関与
BREAKTHROUGH
プロジェクトの突破口FOR THE FUTURE
実験室から工場へ、単糖原料を数百kg、
二糖・三糖を数十kgスケールでの大量製造
FACE
試薬や実験原料を、研究者が手軽に利用できるようにしたい
INTRODUCTION 概要
糖鎖合成ブロックの製造量、
100g単位→100kg単位へ
※糖類合成ブロック:糖類合成の原料となる単糖や二糖、三糖のこと
ヒトゲノムの解読が完了し、核酸(DNAやRNA)、タンパク質に続く、「第3の鎖」として糖鎖が注目を集めています。糖鎖は生体内で多彩な機能を担っており、例えば、細胞の表面にある糖鎖の違いでABO式血液型が決まったり、また、がんの転移やインフルエンザの感染といった病気のメカニズムにも関わっています。糖鎖の研究により、生命現象のさらなる解明や、新しい治療薬の開発が期待されていますが、複雑で多様な構造をもつ糖鎖は、構造解析や合成が難しく、核酸やタンパク質に比べて研究が遅れているのが現状です。そこで、ユニークな試薬の合成を得意とする東京化成工業は、糖鎖の大量合成と関連酵素の製品化に乗り出しました。例えば糖鎖の合成工程を大幅に短縮し、従来よりも安価な糖鎖試薬として販売するなど、研究者がより簡便に糖鎖を研究できる環境の構築に取り組んでいます。長い間、難関とされていた糖鎖研究の扉が開かれつつあります。
BIGINNING 開発への道
細胞の表面を覆う糖鎖、
「細胞の顔」として血液型からインフルエンザまで関与
ヒトの体は約60兆個の細胞から成り、すべての細胞は無数の糖鎖でうぶ毛のように覆われています(図1)。糖鎖は「細胞の顔」として、細胞同士の認識や情報の交換を行い、私たちの体の組織や器官を形成する細胞社会のネットワークを維持しています。
身近な例では、血液中の赤血球の表面にある糖鎖の違いよって、A型、B型、O型、AB型という4種類の血液型に分類されます(図2)。
一方で、細胞表面の糖鎖は、ウイルスが細胞内に侵入する際の目印として悪用されることもあります。例えば、インフルエンザウイルスは「ヘマグルチニン」と「ノイラミニダーゼ」という2つのタンパク質を持っており、ヘマグルチニンが宿主細胞の糖鎖に結合することで、ウイルスが細胞内に侵入します(図3)。
ただし、どのような糖鎖にも結合するわけではありません。ヘマグルチニンのタイプや、糖鎖の形によって結合するか否かが決まるため、ヒトやトリ、ウマなどで、感染するインフルエンザウイルスが異なるのです。
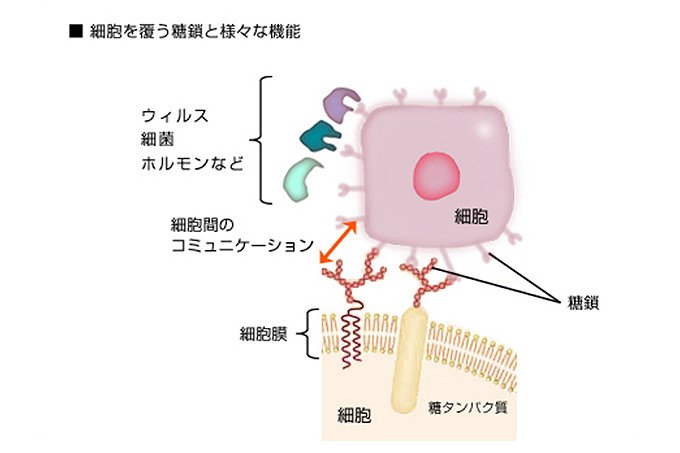
図1 細胞は糖鎖で覆われている。
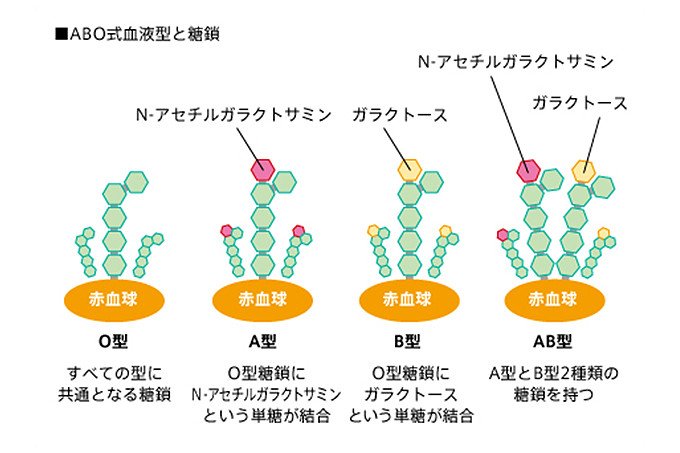
図2 ヒトのABO式血液型は、赤血球表面の糖鎖の末端のわずかな違いによって分類される。
基本型はO型で、A型、B型はそれぞれ別の糖が付加されており、AB型はA型、B型の両方の糖が付加されている。
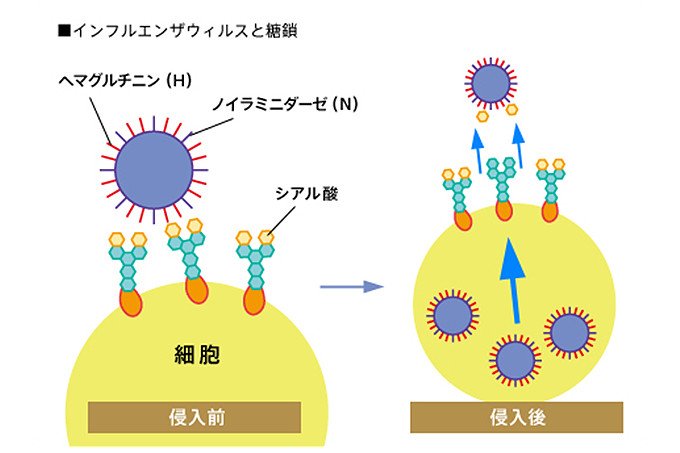
図3 インフルエンザウイルスが持っている「ヘマグルチニン」というタンパク質が宿主細胞の糖鎖に結合して細胞内に侵入し、増殖する。そして、もう一つのタンパク質「ノイラミニダーゼ」が、糖鎖の中の特定の構造を切断することで、ウイルスが細胞内に放出され感染が進行する。リレンザやタミフルは、ノイラミニダーゼが切断する糖鎖とよく似た構造の物質で、これらの薬を投与することで、ノイラミニダーゼを騙し、本来の糖鎖が切断されるのを防ぐ。
糖鎖は複雑で多様な構造をとるため、解析や合成が難しく、研究が遅れていた
「第3の鎖」として注目されている糖鎖ですが、DNAやタンパク質と比べて、研究が遅れているのが現状です。その最大の要因は、糖鎖が複雑かつ多様な構造をとることにあります。糖鎖の機能や構造の解明は極めて難しく、さらに糖鎖の効率的な合成方法がほとんど確立していないことから、研究材料としての糖鎖自体が手に入りにくいのが現状です。
DNAやタンパク質の基本構造は1本の紐状であるのに対し、糖鎖は枝状に分かれた構造をしています。これは、糖鎖の構成要素となる単糖に、複数の結合部分があるからです。どんな糖がどこにどのようにつくか、さらに、糖鎖の長さ、立体構造の違いによっても、糖鎖のもつ情報は異なります。
NEDOでは、「糖鎖機能活用技術開発(2006-2010年)」を始めとして、糖鎖を対象とした産業技術を開発するためのプロジェクトを推進しています。その一環として糖鎖の構造を解析する装置や酵素反応を利用した自動合成システムの開発も精力的に行われ、以前よりも簡便に糖鎖の構造解析ができるようになってきています。
しかしその一方で、糖鎖の大量合成に関しては、決定打となる方法がまだ開発されていません。DNAやタンパク質は、酵母や大腸菌などを使えば、容易に目的のものを増やすことができますが、糖鎖はそのような増殖システムが確立されていません。
糖鎖を人為的に合成することは、構造が複雑であることから非常に難しく、時間も費用もかかかります。研究のための原料や試薬となる糖鎖が、世の中に少量しかなく、販売価格も安くはありません。これがボトルネックとなり、糖鎖研究の裾野を広げる妨げとなっています。
そこで、糖鎖の有機合成のノウハウをもっている東京化成工業は、現状を打開するべく糖鎖の大量合成と、糖鎖を切ったりつなげたりできる酵素の製品化に乗り出しました。有機化学的手法により糖鎖合成が確立できれば、糖鎖の量産化も可能で、様々な分野の研究者に糖鎖を提供することで、糖鎖研究のすそ野を一気に広げることも期待できます。
糖鎖を丸ごと転移させる酵素が、新たな可能性を生み出す
生体内で合成された糖鎖は、タンパク質や脂質に結合することで様々な機能を発揮します。生命活動の主役となるタンパク質の半数以上には糖鎖がついており、糖鎖はタンパク質の働きに大きな影響を及ぼしています。そこで、人為的に糖鎖を別のタンパク質に付加したり、糖鎖を改変したりすることで、結合先の物質の安定化や、新たな機能の付与を実現させようという試みが行われています。
京都大学の山本憲二教授は、タンパク質や脂質に結合している糖鎖をまるごと切り出し、他の物質に移し替える働きをする酵素を、微生物から見つけ出しました。その酵素は「Endo-M」と言います。
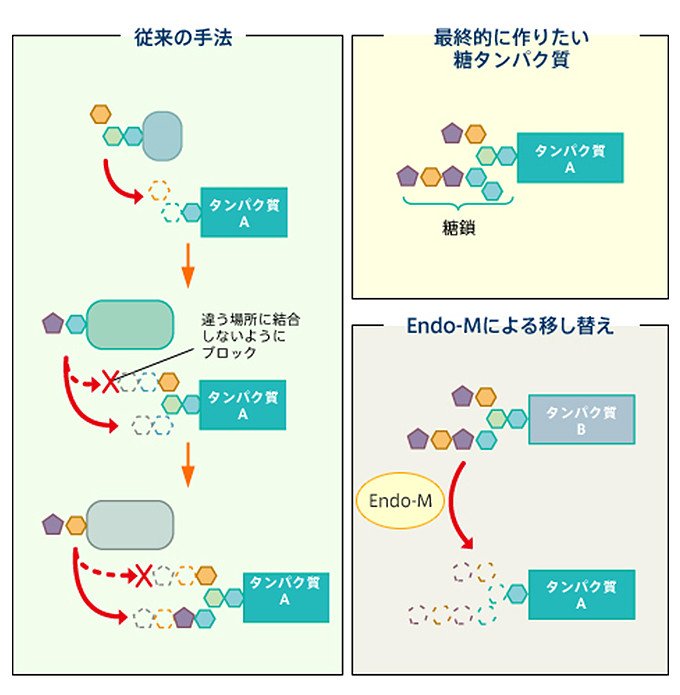
図5 Endo-Mによる糖鎖の移し替えの概念図
これまでにも、似たような働きをする酵素は複数見つかっていましたが、従来の酵素は、決まった構造の糖鎖しか移し替えることができなかったり(専門用語で「基質特異性が高い」と言います)、糖鎖の一部だけを切り出して移し替えたりするものでした。一方、Endo-Mの特徴は、基質特異性が低い、つまり、様々な構造の糖鎖に作用できることです。前ページに述べたように、自然界の糖鎖は多様な形をとりますが、Endo-Mを使うことで、それらを研究開発用の糖鎖の原材料として利用できるようになりました。
山本教授は、Endo-Mを用いて、HIVの候補治療薬であるペプチドに糖鎖を付加することで、ペプチドが分解されにくくなる事を見出しました。また、インフルエンザウイルスの補足型感染阻害ポリマーをEndo-Mを用いて合成する技術の確立にも取り組んでいます。
また、山本教授は「Endo-α」という酵素も発見しています。Endo-αは、特定の二糖をタンパク質やペプチド、糖などあらゆる物質に移し替えることのできる酵素です。
「Endo-Mを広く使ってほしい」という研究者と、「新しいユニークな物質を製品化したい」という意向が共同開発を実現
用途拡大の可能性を持つEndo-Mを、もっと多くの人に使って欲しいと山本教授は考えていました。Endo-Mはキリンビールの研究者が山本教授と共同で、組換え体を作成し、大量生産の道が開けました。この組換え体を譲り受け、そこに、Endo-Mの工業利用を実現させようと名乗り出たのが東京化成工業です。
有機化学の研究者の間では、「目的の試薬が見つからないときは、最後に東京化成工業のカタログを開けばそこにある」と言われるほど、ユニークで新しい物質の合成を、東京化成工業は得意としています。
そのため、東京化成工業は、Endo-Mというこれまでにない、しかも利用価値の高い酵素に強く興味を持ちました。また、有機合成だけではなく、バイオテクノロジーにも積極的に参入していこうという社長の意向もあり、Endo-Mを製品化するための技術開発が実現味を帯びてきたのです。
とは言っても、企業では利益も無視することはできません。珍しい物質であればあるほど、企業にとってその製品化はリスクを秘めたチャレンジになります。そこに、NEDOの「バイオ・IT融合機器開発プロジェクト」が始まりました。健康で長生きできる社会の基盤作りのために、バイオテクノロジーの研究ツールを開発するというこのプロジェクトの目的は、東京化成工業の糖鎖分野への挑戦と一致するものでした。
東京化成工業技術管理本部 技術開発部門 糖鎖技術部の熊田純一チームリーダーは、「生き物を使って安定した品質のものを大量に作るのは簡単ではありません。例えば、同じ醤油を使って同じ料理法で作っているのに、つくる度に味が違っては、研究試薬にはなりません」と話します。
一般的に酵素は、精製しすぎると活性がなくなってしまいます。しかし、製品として販売するには、ある程度の品質が維持され、長期間、酵素活性が保たれるものでなければなりません。熊田さんは「Endo-Mの安定性と機能性を残すために、どの程度精製すればいいか、何回も試験を重ねました。Endo-Mを均一に精製する方法を確立できたのは、NEDOの支援があったからこそです」と振り返ります。

Endo-Mの遺伝子を酵母に導入して、酵母にEndo-Mを作らせる。写真はEndo-Mの遺伝子を導入した酵母を研究培養しているところ。東京化成工業王子研究所にて

東京化成工業が製造販売する、100mU(U=ユニット)入りのEndo-M試薬
費用・労力・時間を大幅に削減し、目的の糖鎖を大量合成
一方で、糖鎖を付加したり、改変したりする酵素があっても、肝心の糖鎖が高価で入手困難では研究が進みません。東京化成工業では、糖鎖研究に革新をもたらすために、糖鎖の大量合成という、切望されている難題にも同時に取り組みました。
通常、糖鎖の有機合成は、原料である単糖を結合させ、鎖状にしていきます。しかし、一つの単糖には次の単糖と結合できる部分が複数存在し、さらに結合の様式も2種類あります。そのため、目的の部分を活性化させ、それ以外の結合部分は保護基でブロックして、縮合反応により糖をつなぎます。
これで1段階目の反応が終わり、2個の単糖がつながった「二糖」ができます。同様の作業を繰り返すことで、3個、4個・・・とつながった糖鎖をつくることができます。
これだけでも高度な技術と相当な労力が必要ですが、その後、合成した糖鎖を「精製」するための作業が必要になります。その際に有機溶媒を大量に用いることから環境問題も懸念されます。
東京化成工業では、原料となる単糖の形に工夫を加えたり、反応の条件を変えたりすることで、糖鎖の結晶性を上げることに成功しました。つまり、合成した後の糖鎖の精製が飛躍的に容易になったのです。さらに、多様な単糖を原料として準備できるようになり、工程数が格段に少なくなりました。こうして、一度に大量の糖鎖を合成することが可能になったのです(図6)。
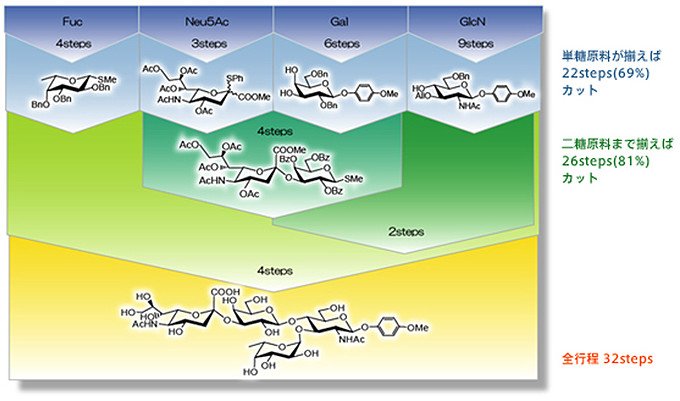
図6 工程の大幅な短縮。Sialyl Lexという四糖を合成する場合の例
BREAKTHROUGH プロジェクトの突破口
通常、混合物から糖鎖を精製するには「カラムクロマトグラフィー」という方法を用います。これは、物質の性質によって混合物を液体の状態で分離する精製方法です。カラムクロマトグラフィーの場合は、カラム(柱状の容器)にシリカゲルなどの「充填剤」を詰め、展開溶媒(有機溶媒)と反応混合物の溶液をカラムに流します。すると、充填剤との親和性や、物質の大きさなどによって、流れ出てくるスピードが異なり、試験管などで一定量ずつ採取することで、目的の物質を精製することができます。しかし、精製には時間がかかり、また大量の溶媒が必要となります。
東京化成工業が合成した糖鎖合成原料のほとんどは、純粋な結晶で得られます。しかも結晶は粉の形状です。そのため、基本的にカラムクロマトグラフィーを行う必要はありません。通常、1-2キログラムの精製の場合、カラムクロマトグラフィーで使用する充填剤は混合物に対して約10倍、流す展開溶媒はドラム缶くらいの量が必要になります。カラムクロマトグラフィーを回避することで環境への負荷が軽減され、さらに、一度に大量の糖鎖を合成することが可能になったのです。

単糖原料を混ぜ合わせ、糖鎖を合成しているところ(実験室でのデモンストレーション写真)

図8 工場レベルでの糖鎖合成の工程。大型の低温反応釜で単糖原料を反応させ、糖鎖を合成し、結晶化や乾燥の工程を経て、カラムクロマトグラフィーを行わずに、目的の糖鎖が粉末状で得られる。
FOR THE FUTURE 開発のいま、そして未来
実験室から工場へ、
単糖原料を数百kg、二糖・三糖を数十kgスケールでの大量製造
多数の糖鎖を合成し、販売している東京化成工業ですが、目指すのは工場レベルでの糖鎖の大量合成です。現在、大型の反応釜を用いて数十~数百kgスケールの各種単糖原料を合成し提供した実績もあります。さらに、数kg~数十kgスケールで二糖・三糖を合成することも可能です。
これらの化学合成した糖鎖や、Endo-Mなどを駆使して、数多くの糖鎖を製品化しています。例えば、O-157ベロ毒素と結合する糖鎖、癌細胞に特異的に発現する糖鎖、ES細胞やiPS細胞のマーカーとして存在する糖鎖などを合成し、販売しています。
今後は、糖鎖の種類を増やすとともに、脂質やタンパク質に付加することのできる各種糖鎖や、蛍光基などをつけた糖鎖など、様々なユーザーのニーズに応えた糖鎖を、迅速かつ大量に合成し、提供していく予定です。東京化成工業の糖鎖分野への挑戦に携わってきた技術管理本部 技術開発部門 糖鎖技術部の松﨑祐二マネージャーは、「合成原料やツールを研究者の方々に提供できる環境を整え、糖鎖研究の推進や医薬品開発のお手伝いをしていきたいと考えています」と今後の展望を話します。

人工合成された、糖鎖の粉末
「やれば、できる」ではなく、
「やったからこそ、できた」で世の中は動く
特定の糖鎖を販売している企業はありますが、糖鎖全般を合成し、販売している企業は少なく、広範な糖鎖をターゲットとした大量合成を実践したのは東京化成工業だけといっても過言ではありません。未知なことの多い糖鎖を生産して、意味はあるのか、本当に売れるのか、といった疑問の声は当然あがります。
しかし、松﨑さんは言います。「NEDOの支援のおかげで、様々な糖鎖を、しかも、それぞれかなりの分量を生産する技術が確立できつつあります。 "やれば、できる"では、ものは売れませんからね。"やったからこそ、できた"と言えるようになったのは、ありがたいことです」
研究者の間で、Endo-Mの認知度が高まり、販売量も右肩上がりで伸びていると松﨑さんは言います。これからは、より反応効率を上げた改良型Endo-Mの販売に向けて研究を進めていきます。
Endo-Mの粉末X
開発者の横顔
試薬や実験原料を、研究者が手軽に利用できるようにしたい
東京化成工業株式会社 技術管理本部 技術開発部門 糖鎖技術部の松﨑マネージャーは、20数年間、多くの研究者と関わりながら糖鎖研究に携わっています。「糖鎖の合成研究は、多くが大学や国の研究所で進められています。ですが、論文を投稿した後に改めて糖鎖を再合成して提供することは残念ながら困難な状況です。試薬会社として、その代行が出来るようになりたいと思います。大型の製造設備で、糖を専門としない製造員が数十キロの縮合反応(糖を繋げる反応)を行なったことで夢が広がりつつあります」

東京化成工業株式会社
松﨑さん
糖鎖技術グループの石田秀樹グループリーダーも大学時代から糖鎖研究に関わり、約20年間、糖鎖の合成を専門にした後、東京化成工業で糖鎖の大量合成を研究しています。「自分がこれまで実験室レベルで作っていた糖鎖が、工場という大きなスケールで製造できるということが体験できて世界観が変わりました。糖鎖の合成にはまだまだ試行錯誤が必要ですが、確かなものを早くお客様に提供することを心がけています」

東京化成工業株式会社
石田さん
一方、糖鎖バイオチームの熊田純一チームリーダーは、微生物が専門で、工場と実験室を兼務しています。「微生物を使ってものを作るには時間がかかります。決して効率のいい商売ではありません。ですが、生産量を上げるということが工場の使命です。また工夫をして、迅速に安定した品質で製品を提供できるよう、品質管理に力を入れています」

東京化成工業株式会社
熊田さん
なるほど基礎知識
糖鎖は、単糖と呼ばれる糖の分子が鎖状につながったものです。例えば、栄養素としてよく知られているデンプンは、グルコースという単糖がたくさんつながった糖鎖の一種です。
我々が穀物などを摂取すると、それに含まれるデンプンが酵素によって分解されて、最終的には単糖であるグルコースになり、エネルギーとして利用されます。 紙や衣類の原料となるセルロースもやはり糖鎖の一種で、構成要素はグルコースです。しかし、デンプンを構成しているグルコースとはわずかに構造が違います。その違いのために、セルロースの性質はデンプンとは全く異なっています。
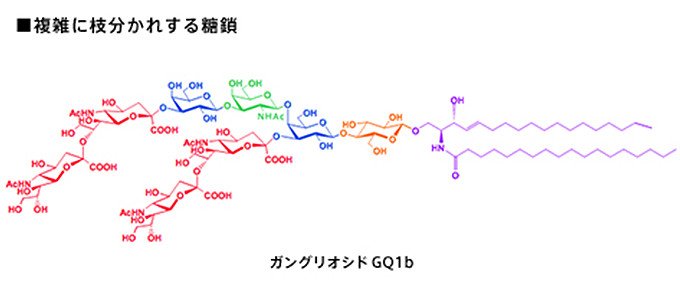
図4 脳から見つかった糖鎖「ガングリオシド」、複数の種類の糖が多数、枝分かれして繫がっている。図は、その一つである「ガングリオシドGQ1b」の構造で、ボツリヌス毒素のレセプターや、神経機能の調節などに関与していると考えられている。また、これより短い構造の「ガングリオシド」糖鎖には、癌細胞に発現するものもあり、癌発見のマーカーとしても注目されている。
私たちヒトは、ヒツジやヤギ、ウマ、ゾウなどの草食動物と違って、紙を食べてもエネルギーとして使うことができません。それは、こうした草食動物の体内には、セルロースを分解する酵素をつくる微生物が共存しているのに対して、ヒトの体内にはそのような微生物が存在しないからです。
これらのデンプンやセルロースは、グルコースという1種類の単糖が鎖状につながったものですが、ヒトの体内で利用されている単糖は10種類にのぼります。複数の種類の単糖がつながる際の組み合わせや順番、さらに、結合の位置の違いや鎖の枝分かれなどにより、糖鎖は無数の構造を作ることができ、その働きも変わってきます。
お読みいただきありがとうございました。
ぜひともアンケートにお答えいただき、
お読みいただいた感想をお聞かせください。
いただいた感想は、
今後の連載の参考とさせていただきます。